A hemochromatosis a vasanyagcsere zavara, amelynek lényege, hogy a fokozott vasfelszívódás annak lerakódásához és következményes szövetkárosodáshoz vezet. Magyar neve a „bronzdiabétesz” a jellegzetes bőrszínre, valamint a parenchymás szervek, köztük a hasnyálmirigy károsodására, a következményes diabetesre utal.
Esetünk érdekessége, hogy a betegünknek egy másik, genetikailag meghatározott rendszerbetegsége, lisztérzékenysége is van, ami valószínűleg némileg befolyásolta a kórlefolyást.
Következtetéseink: Frissen felfedezett cukorbetegség esetén gondoljunk pancreast érintő rendszerbetegségre is. Betegünk esetében a társuló coeliakia mérsékelhette a vas korlátlan felszívódását, így befolyásolhatta a klinikai képet.
Az öröklődő hemochromatosis a jelenleg ismert leggyakoribb, genetikai eredetű betegség. Autoszómához kötött recesszív módon öröklődik, manifesztációja nemtől függő, férfiak esetében ötször gyakoribb, mint nőkben.
1996-ban Feder és munkatársai azonosítottak egy új gént (HLA-H gén, felfedezőjéről HFE gén) a hatodik kromoszóma rövid karján, amelynek egyik pontmutációja a 845. nukleotidon G-A csere következtében a 282. aminosavhelyen cisztein tirozinra történő cseréjét eredményezi (C282Y). Az azóta elvégzett vizsgálatok során a hemochromatosisban szenvedő betegek 64–100%-ában homozigóta formában sikerült kimutatni ezen mutációt. A homozigótagyakoriság európai populációban 0,1%–0,3%, minden 10 000 élveszületésre kb. 25 HH homozigóta jut.
A másik ismert mutáció, amely a kaukázusi populációban ritkább, a 187. nukleotidpozícióban C-G csere miatt a 63. aminosavhelyen hisztidin helyett aszpartátot eredményez.
Esetismertetés
A 64 éves férfibeteget körzeti szűrővizsgálaton figyelmeztették magasabb vércukorszintértékeire, amely miatt diétát tartott, később metformin-kezelést kapott. Panaszként időnkénti térdfájdalmakat említett.
Fizikális vizsgálattal kisfokú hepatomegaliát említhetünk.
Hasi ultrahangvizsgálat diffúz májlaesiót és kisfokú splenomegaliát mutatott.
Laboratóriumi vizsgálatokból magasabb éhomi vércukorszint: 7,9 mmol/l (normálérték: 5,6 mmol/l-ig), HbA1C: 6,9% (normálérték: 6,0%-ig), illetve 52 mmol/mol (normálérték: 42 mmol/mol-ig), jelentősen emelkedett szérumvasszint: 41,2 μmol/l (normálérték: 31,3 μmol/l-ig), transzferrinszaturáció: 83,24% (normálérték: 45%-ig), illetve szérumferritinszint: 968,7 ng/ml (normálérték: 231,7 ng/ml-ig) emelendő ki. Megemlítendő még a tTGIgA-pozitivitása: 43,0 U/ml (normálérték: 10 U/ml-ig) és a CA 19-9-koncentráció emelkedettsége: 49,3 U/ml (normálérték: 37 U/ml-ig).
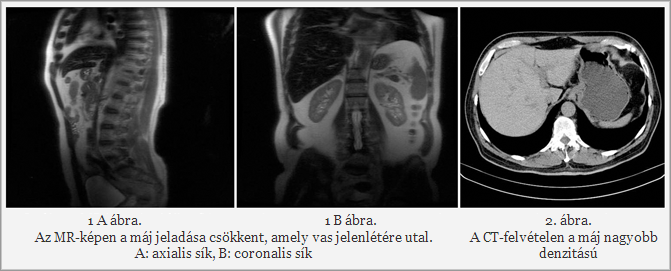
A has MR-vizsgálata natívan a máj jeladását minden mérésen jelentősen csökkentnek mutatta (1., 2. ábra), amely vas jelenlétére utalt, ennek megfelelően a natív CT-felvételen a máj diffúzan nagyobb denzitású volt (3. ábra).
A genetikai vizsgálat szerint a beteg mindkét HFE/HLA-H génje/allélja tartalmazza a Cys282Tyr (C282Y) aminosavcseréhez vezető pontmutációt, tehát homozigóta a vizsgált mutációra.
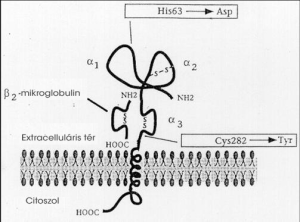
A megváltozott vasfelszívódás magyarázata
A HFE génben a 845. nukleotidon G-A csere következtében a 282. aminosavhelyen cisztein helyett tirozin épül be (3. ábra). A HFE gén által kódolt fehérje elsődleges szerkete hasonlít az MHC I. osztályba tartozó HLA-A, HLA-B, HLA-C által kódolt fehérjékhez. A nehézláncon van a transzmembrán domén. A sejten kívüli részén három domén van disszulfidhidakkal összekötve, a ß2 mikroglobulin, a könnyűlánc nem kovalens kötéssel kapcsolódik a nehéz lánchoz. A HFE gén által kódolt fehérjemolekula a bélhámsejtek transzferrinreceptorával komplexet képezve csökkenti annak transzferrinkötő képességét. A cisztein-tirozin aminosavscsere miatt a normális diszulfidhíd nem tud kialakulni, a nehézlánc nem tud ß2 mikroglobulinnal kapcsolódni, így nem expresszálódik a sejtfelszínen, a transzferrinreceptorhoz nem tud kapcsolódni, ezért a véráram felől nem tud vasat felvenni a bélhámsejt, úgy érzékeli, hogy a vasraktárak üresek, és fokozódik a béllumen felől a vas felszívódása. A H63D mutáció nem befolyásolja a fehérje sejtfelszíni expresszióját és a transzferrinreceptorhoz való kötődését sem, azonban a vad típusú fehérjével ellentétben csökkenti a receptor ligandkötő képességét.
A létrejövő szövetkárosodások patomechanizmusa
A nagy mennyiségű vas lerakódása következményes szövetkárosodáshoz vezet, főként a parenchymás szervekben. Az átlagos étrend napi megközelítőleg 10 mg vasából nagyjából 10% szívódik fel, döntően a duodenumból, míg öröklődő hemochromatosisban ez napi 3-4 mg. A progresszív vaslerakódás miatt rendszerint a betegek 40-50 éves kora körül a hemochromatosis tünetei jelentkeznek (fáradékonyság, ízületi fájdalom, impotencia, májmegnagyobbodás, bőrpigmentáció, a szénhidrátháztartás felborulása), amelyek hátterében visszafordíthatatlan szervkárosodások állnak (például májcirrhosis vagy -carcinoma, arthropathia, a pancreas-sziget-sejtek diabetes mellitushoz vezető károsodása, azaz „bronzdiabétesz”, hypogonadotrop hypogonadismus, cardiomyopathia).
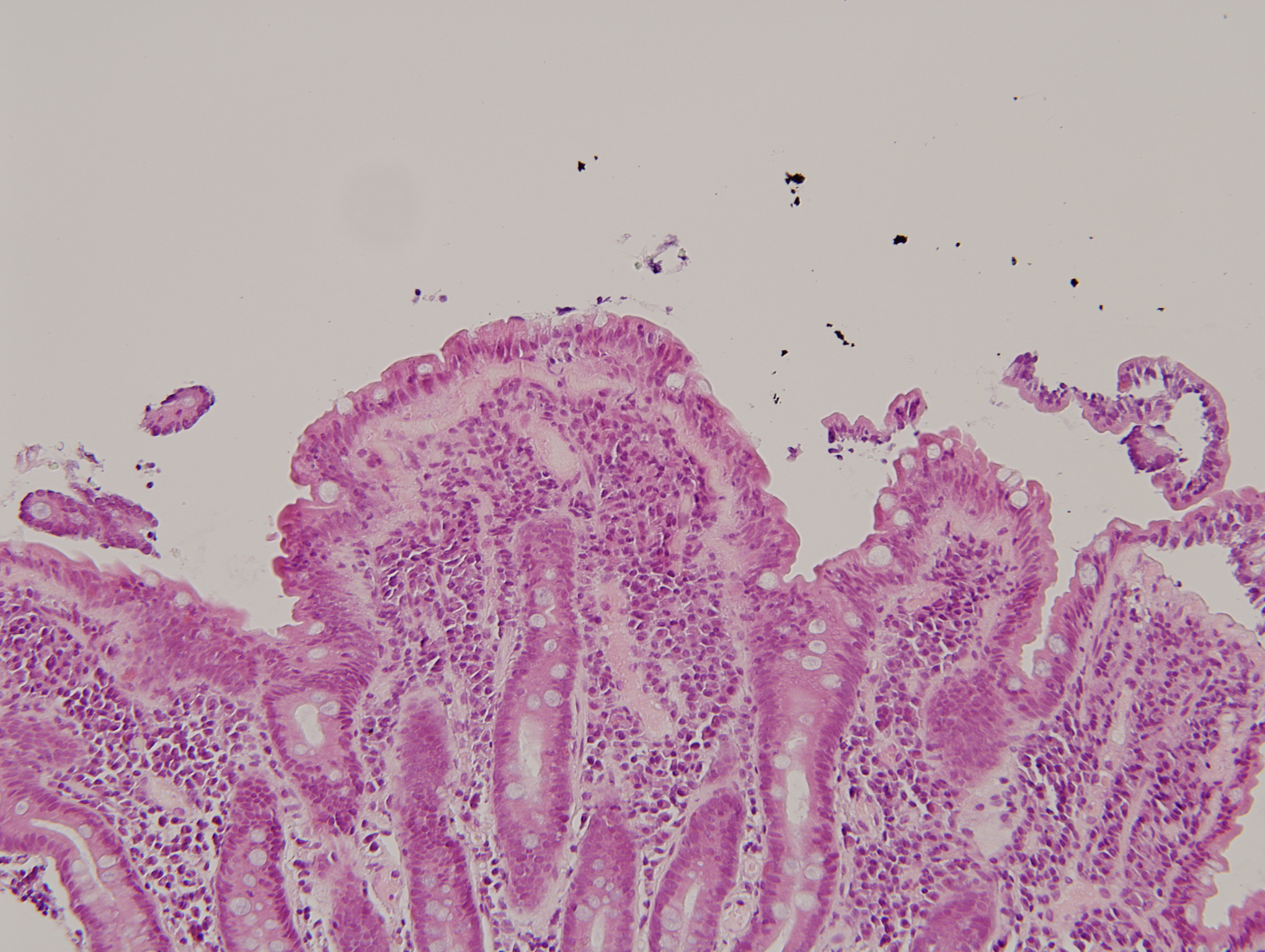
Esetünk további érdekessége, hogy bár ilyen jellegű panasza nem volt, de tTGIgA pozitivitása miatt a mély duodenumból biopsziát vettünk. A vékonybél makroszkópos megjelenése ép volt. A hisztológiai eredmény Marsh 3/b stádiumú boholyatrophiát mutatott (4. ábra).
Ismételt genetikai vizsgálatot kértünk a HLADQ-2, DQ-8 status felderítésére. A DQ gének által kódolt molekulák heterodimérek, a két polipeptid láncát (alfa, béta) különböző gének (DQA1 és DQB1) kódolják, ha ciszhelyzet, akkor egy kromoszómán van a két allél, ha transzhelyzet, akkor két kromoszómán, anyain és apain van a két allél. A betegek több mint 90-95%-a hordozza a HLA DQ2 (DQA1*05, DQB1*02) és 5-10%-a a DQ8 (DQA1*03, DQB1*0302) heterodiméreket kódoló humánleukocita-antigének (HLA) DQ-alléljait. Betegünk az MHC II. osztályú antigének (DQA1*0102, DQA1*0501, DQB1*0201, DQB1*0602) pozitivitása alapján hordozza a hajlamosító DQ2 antigént.
Az MHC gének öröklésmenete
Kodomináns öröklésmenet, azaz mindkét szülő haplotípusa (allélvariánsa) expresszálódik. A haplotípusokra példa:
Öröklődés: ab x cd → ac, ad, bc, bd
A lisztérzékenység immunológiai háttere
A coeliakia gabonafélék (búza, rozs, árpa, zab) gluténfrakciója által indukált autoimmun enteropathia. Az európai lakosság 1%-a érintett. Az ok ezekben a növényi magvakban lévő glutén hatására végbemenő immonológiai reakció, amiért a glutén alkohololdékony frakciója, a glutaminban és a prolinban gazdag gliadin a felelős. A glutén a szöveti transzgultamináz (tTG) szubsztrátja, az enzim a pozitív töltésű glutamint negatív töltésű glutaminsav-maradékká deaminálja. A bél tTG-TG2 funkciója a glutamin-lizin oldalláncok transzamidálása, fehérjék közti keresztkötések képzése, bizonyos körülmények között az enzim deaminálásra is képes. Extra- és intracellularis térben is előfordul, 687 aminosavból áll. A TG2-n kívül még nyolcféle ismert, például TG3 epidermalis transzglutamináz a dermatitis herpetiformisban. A negatív töltésű gluténfragment (50–100 aminosavból álló oligopeptid) nagy affinitással kötődik az antigénprezentáló (itt dendriticus) sejtejken expresszálódó, pozitív töltésű HLA II. osztályba tartozó HLA-DQ2/DQ8 molekulákhoz. E fenti komplex kapcsolódik a speciális CD4+ (T-segítő) fehérvérsejtekhez, ezzel beindítja a különböző gyulladáskeltő anyagok termelését (interferon-γ, TNF-α, interleukin-6 és interleukin-2).
Klinikai lefolyás
Az öröklődő hemochromatosis kórisméjének felállítása óta a diéta mellett közel négyhetente végzünk 400 ml-es vérlebocsátásokat, a harmadik vérlebocsátás után a szérumferritinszint még jelentősen magas ugyan (773,2 ng/ml), de a szérumvasszint már normális (26,1 μmol/l), és a transzferrinszaturáció is jelentősen javult (48,32%). Az éhomi vércukorszint normális (4,6 mmol/l), a beteg elhagyta a metformin-terápiát.
Következtetések
Frissen felfedezett cukorbetegség esetén gondoljunk pancreast érintő rendszerbetegségre is.
Betegünk esetében a társuló coeliakia mérsékelhette a vas korlátlan felszívódását.
A képek rendelkezésre bocsátását köszönjük dr. Cserepes Éva (Radiológiai Osztály) és dr. Szabó Zsuzsanna (Patológiai Osztály) kollégáknak.