A katasztrofális antifoszfolipid-szindróma (CAPS) az antifoszfolipid-szindróma (APS) nagyon ritka variánsa, amely a különböző szervek thromboticus érintettségével vagy szisztémás, illetve szöveti microthrombotisatióval jellemezhető. Maga a szindróma ritkán fordul elő, az antifoszfolipid-szindrómás esetek alig 1%-át teszi ki, azonban életveszélyes állapotot okozhat.
Az ismertetett betegnél az egyszerű alvadási tesztekkel a laboratóriumban kimutatott és követett CAPS-szerű antifoszfolipid-szindróma kevesebb mint egy hét leforgása alatt alakult ki.
A 68 éves férfi beteg esetében három héttel korábban kezdődő mellkasi panaszai, erős köhögése és véres köpete miatt echokardiográfiai, majd CT-vizsgálatot végeztek, ezek eredménye alapján kardiológiai osztályos felvételre került. Felvételekor a beteg teljesen panaszmentes volt.
Korábbi anamnéziséből kiemelendő a többszöri tumoros folyamat:
1998.: világossejtes veserák,
2004.: rectumtumor,
2009.: jobb oldali pleuralemezen megtapadt tumor miatt reszekció.
Az echokardiográfiai vélemény: jó balkarma-funkció, az aorta- és a tricuspidalis szájadékok enyhe inszufficienciája, utóbbi miatt emelkedett pulmonalis nyomás.
A CT-lelet eredménye: lovagló thrombus, mindkét tüdőfélben metastasisok.
A kezelés infúziós Na-heparin-terápiával indult, az alvadási pareméterek monitorozásának eredményét az 1. ábra szemlélteti. Az első nap protrombinidőt (PI), aktivált parciális tromboplasztinidőt (APTI) és trombinidőt (TI) mértünk, amelyet a többi napon a klinikus által kért APTI-vizsgálatok követtek. Ezt követően eredménytől függően a laboratóriumban indikáltak időszakos protrombinidő-, trombinidő- és fibrinogénszint-méréseket is. Az INR minden alkalommal 1,3 alatt maradt, a fibrinogénkoncentráció értéke 4,33 g/l volt.
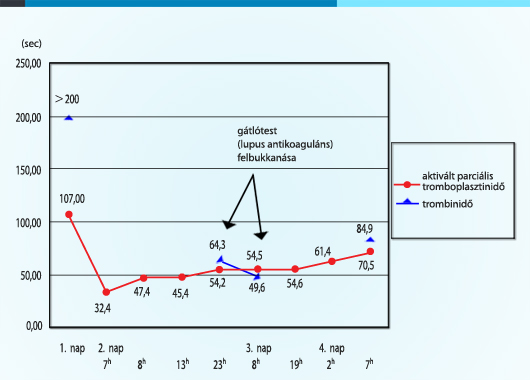
Az első napi eredményekhez viszonyítva a második nap folyamán csak gyenge heparinhatás volt sejthető az APTI másfélszeres megnyúlása mellett (a klinikai kontrollvizsgálatok leletei 30,6‒31,4 sec között mozogtak). Feltételezve a megfelelő terápiás és mintavételi viszonyokat, a laborban mérték a trombinidőket a heparin hatásosságának ellenőrzésére.
A trombinidő jelentősen eső értékei, valamint az emelkedő, illetve időszakosan a trombinidőt is meghaladó APTI-értékek egyrészt a heparin nem kellő hatását jelzik (heparinrezisztencia?), másrészt felvetik annak a valószínűségét, hogy az APTI megnyúlását nemcsak a heparinkezelés okozza (gátlótest?).
Az előbbi miatt a heparin hatástalanságát feltehetően kiváltó és a thrombosissal összefüggésbe hozható antitrombin-III (AT-III) deficienciája okolható. Ennek magyarázata pedig olyan etiológiai tényező lehet, amelynek jelenléte önmagában is thrombosisra hajlamosít: a lupus antikoaguláns (foszfolipid elleni gátlótest, LA) jelenléte.
A lupus antikoaguláns megjelenése in vitro az alvadási idő megnyúlását produkálja olyan foszfolipidet igénylő laboratóriumi tesztekben, mint például az APTI mérése. Ezért a lupus antikoaguláns szűrőtesztjeként az APTI-vizsgálat alkalmazható, amennyiben egyéb zavaró interferáló tényezőt, például a heparin hatását ki lehet zárni. Mivel jelen esetben a tesztet a heparin jelenléte zavarhatja, a gyanút heparinra kevéssé érzékeny megerősítő teszttel támaszthatjuk alá. Az AT-III- és az LA-vizsgálat feltételezésünket igazoló eredményeit a 1. táblázat mutatja.
1. táblázat. Az antitrombin-III-aktivitás és a lupus antikoaguláns jelenlétének mérései és eredményei
| 1. Antitrombin-III-aktivitás mérése: | |
| Progresszív trombingátló aktivitás mérése heparin jelenlétében. | |
| Reagens: Stachrom AT-III Kit, Stago | |
| (feltétel: a terápiás heparin nem befolyásolja). | |
| Eredmény: | |
| A 3. napon az AT-III: 72% (referenciatartomány: 80–120%). | |
| 2. Lupus antikoaguláns (LA) mérése: | |
| Hígított-tromboplasztin-időráta-vizsgálattal. | |
| Reagens: Innovin, Baxter | |
| (feltétel: INR<1,3). | |
| Eredmények: | |
| hPI 50x: 1,48 (normálérték: <1,2) | |
| hPI 500x: 1,99 (normálérték: <1,2) | |
| LA+ | |
| Vélemény | |
| 1. Heparin- (AT-III-) rezisztencia? | |
| 2. Lupus antikoaguláns (LA) jelenléte? | |
Időközben a lovagló thrombuson kívül pulmonalis és szisztémás szöveti microthrombotisatio jeleit is lehett tapasztalni, amelyek nem szervspecifikus tünetekben is megnyilvánultak. A folyamat rapiditása, a szervi és szöveti thrombotisatio ténye, valamint az LA-pozitivitás feltűnően emlékeztetett a katasztrofális antifoszfolipid-szindrómára1 (CAPS) (2. táblázat).
2. táblázat. A katasztrofális antifoszfolipid-szindróma diagnosztikai kritériumai1
| 1. Három vagy több szerv- vagy szövetérintettség bizonyítéka*. | |
| 2. A manifesztációk szimultán vagy legfeljebb egy hét alatt alakulnak ki. | |
| 3. Kis ér elzáródásának hisztopatológiai igazolása legalább egy szervben vagy szövetben**. | |
| 4. Antifoszfolipid antitestek (lupus antikoagulans vagy antikardiolipin antitestek) jelenlétének laboratóriumi igazolása***. | |
| Egyértelmű CAPS: A fenti négy kritérium együtt. | |
| Lehetséges CAPS: Bármely az alábbiak közül: | |
| a) A fenti négy kritérium, eltekintve attól, hogy csak két szerv vagy szövet érintett. | |
| b) A fenti négy kritérium, eltekintve a legalább hat héten túli laboratóriumi megerősítések hiányától, ha a beteg korai halála miatt – a CAPS-ot megelőzően – egyáltalán nem történt aPL-vizsgálat | |
| c) Az 1., a 2. és a 4. kritériumok. | |
| d) Az 1., a 3. és 4. kritériumok és egy harmadik esemény kialakulása az antikoagulálás ellenére egy hét és egy hónap között | |
| *Általában érelzáródások klinikai bizonyítéka, megfelelő képalkotó technikával megerősítve. Veseérintettég, amelyet a szérumkreatinin-szint 50%-os emelkedése, súlyos magas vérnyomás (>180/100 Hgmm) vagy proteinuria (>500 mg/24 óra) határoz meg. | |
| **A szövettani megerősítéshez jelen kell legyen a thrombosis egyértelmű bizonyítéka, bár néha vasculitis egyaránt lehetséges. | |
| ***Amennyiben a betegnél korábban nem diagnosztizáltak APS-t, a laboratóriumi megerősítés megköveteli az antifoszfolipid antitestek jelenlétének legalább hat hét múlva történő kettő vagy többszöri meghatározását. | |
| aPL: antifoszfolipid antitestek, APS: antifoszfolipid szindróma, CAPS: katasztrofális antifoszfolipid szindróma | |
A laborvizsgálat eredménye után antikoagulálás-váltás történt. A továbbiakban a folyamat a kórkép ritkaságából adódó terápiás bizonytalanság miatt ugyan lassan, de szanálódott.
Megbeszélés, következtetés
A mi esetünkben a kezdeti thrombotisatio és feltehetően az emiatt csökkent heparinérzékenység (fokozott antitrombin-III-felhasználás) vetette fel a többi alvadási paraméter és a lupus antikoaguláns vizsgálatát, és vezetett el az antifoszfolipid-szindróma diagnózisának kimondásához. Az etiológiai tényező (neoplasma) valamint a lupus antikoaguláns jelenléte melletti pulmonalis és szöveti microthrombotisatio további gondolatokra késztetett bennünket, és felmerült a katasztrofális antifoszfolipid-szindróma lehetősége.
Bár a katasztrofális antifoszfolipid-szindróma ritkán fordul elő (az antifoszfolipid-szindróma eseteinek csupán 1%-ában), a mortalitás mintegy 50% lehet2, 3.
Irodalom
1. Asherson RA, Cervera R, de Groot PR, et al; Catastrophic Antiphospholipid Syndrome Registry Project Group. Catastrophic antiphospholipid syndrome: international consensus statement on classification criteria and treatment guidelines. Lupus 2003;12:530-4.
2. Erkan D, Cervera R, Asherson RA. Catastrophic antiphospholipid syndrome: where do we stand? Arthritis Rheum 2003;48:3320-7.
3. De Carvalho JF, Pereira R, Shoenfeld Y. Current knowledge regarding Ashershon’s Syndrome. Exp Review Clin Imm 2009;5(5):587-91.







