A 42 éves nőbeteg képalkotó vizsgálatokkal igazolt pneumoniával, ileitis terminalissal, hydropsosan tágult epehólyaggal, ileussal került intenzív osztályunkra. Kolonoszkópiával egy vérzékeny, neoplasztikusnak imponáló területet találtunk, aminél az ischaemiás eredet is felmerült.
Az antibiotikus terápia, konzervatív kezelés ellenére perzisztáló szeptikus sokk alakult ki, az ileus nem oldódott. A sebészi exploráció purulens peritonitist, nekrotikus coecumot és colon ascendenst talált, jobb oldali hemicolectomia, ileotransversostomia történt.
Ismételten fellángoló szeptikus epizódok miatt elhúzódó, többször is módosított antibiotikus terápia, egy alkalommal reoperáció történt. Multirezisztens kórokozók jelentek meg, végül uralhatatlan szeptikus állapot következményeképp a beteg 57 nap intenzív osztályos kezelés után elhunyt.
A szeptikus betegek kezelése világszerte jelentős kihívások elé állítja az orvostudományt. Ezen kihívások egyike az időben megkezdett, ugyanakkor megfelelő spektrumú antibiotikum kiválasztása (1). A kezelés kezdetén sok esetben ismeretlen a kórokozó, így empirikus terápia bevezetése szükséges. Számos alkalommal a gyulladásos fókusz sebészi eradikációja nem lehetséges, így az antibiotikumok maradnak a bakteriális fertőzés kezelésének legfontosabb fegyverei.
Még a megfelelően megválasztott antibiotikus terápia mellett is szelektálódhatnak azonban olyan kórokozók, amelyek egyre több készítménnyel szemben mutatnak rezisztenciát, végül megjelenhetnek olyan mikroorganizmusok, amelyek csak néhány antibiotikummal kezelhetőek, vagy akár az elérhető szerek közül egy sem hatékony.
Esetismertetésünk során olyan beteg történetét mutatjuk be, akinél a számos leoltási eredmény birtokában végzett célzott antibiotikus kezelés mellett intézetünkben észleltük Magyarországon az első, izolált multirezisztens, széles spektrumú β-laktamáz (extended spectrum β-lactamase, ESBL) és Verona-integron-kódolt metallo-β-laktamáz (Verona integron-encoded metallo-β-lactamase, VIM-4) karbapenemáztermelő Klebsiella pneumoniae ST15 klón megjelenését.
Esetismertetés
A 42 éves, krónikus obstruktív tüdőbetegségben, ischaemiás szívbetegségben, dilatativ cardiomyopathiában szenvedő, 15 éve hátsó fali myocardialis infarctuson átesett, aktuális felvétele előtt egy hónappal jobb oldali pneumonia és hydrothorax miatt kezelt nőbeteget az órák óta tartó felhasi és mellkasi fájdalmak miatt hozta be a mentőszolgálat.
Globális légzési elégtelenség miatt a helyszínen endotrachealis intubáció történt, gépi légzéstámogatás indult. Intenzív osztályos felvételét követően hemodinamikai instabilitás miatt centrális vénakanülálás, artériás kanülbehelyezés történt, kombinált katecholaminterápia (noradrenalin+dobutamin) vált szükségessé.
Fizikális vizsgálat során obesitast, kétoldali kifejezett bronchospasmust, sinustachycardiát, hypotensiót, feszes, nyomásérzékeny, disztendált, néma hasat találtunk. A képalkotó vizsgálatok (mellkasröntgen, hasi ultrahang, hasi CT) jobb oldali basalis pneumoniát, ileitis terminalist, hydropsosan tágult epehólyagot, ileust igazoltak. A laboreredmények mérsékelt azotaemiát (karbamidnitrogén: 11,3 mmol/l, kreatinin: 101 µmol/l), emelkedett gyulladásos paramétereket (fehérvérsejtszám: 22,1 G/l, C-reaktív protein: 36,3 mmol/l) mutattak. Empirikus ciprofloxacin+metronidazol terápia indult.
Az elsődleges sebészeti vizsgálat a beteg általános állapota miatt sebészeti teendőt akutan nem tartott indokoltnak, az ileus konzervatív kezelését javasolta. Kolonoszkópiával a flexura hepaticától orálisan egy vérzékeny, neoplasztikusnak imponáló területet találtak, azonban ischaemiás eredetet is felvetettek. A prokinetikus, bélmozgató kezelés ellenére az atonia növekedett, az ileus nem oldódott, perzisztáló szeptikus sokk alakult ki.
Ismételt sebészeti konzílium akut laparotomia mellett döntött. Exploráció során purulens peritonitis, áteresztő, nekrotikus coecum és colon ascendens igazolódott. (Mikroszkóposan: a coecum és a colon ascendens kimetszéseiben nagy területen létrejött, az egész bélfal vastagságát érintő elhalás, bélinfarctus.) Jobb oldali hemicolectomia, ileotransversostomia történt. A műtéti szituációra, perzisztáló szeptikus állapotra tekintettel az antibiotikus terápiát hét nap után meropenemre váltottuk. A posztoperatív szakban a beteg állapota átmenetileg javult, a katecholamin elhagyható volt, majd ismételt igény jelentkezett. Tracheaváladékából ekkor még multirezisztensnek nem számító Acinetobacter baumannii tenyészett ki, amely meropenemre érzékenynek bizonyult.
A műtét utáni negyedik napon (10. ápolási nap) meropenem mellett lázkiugrás (40,5 oC), hasi defenzus lépett fel. A 11. ápolási napon reoperáció történt, amely során zavaros ascitest, korábbi peritonitis nyomait, zsírnekrózist, ép ileotransversostomát találtak. Hasűri lavage-t, drenázst, hasfali resuturát végeztek. A sebváladékból csak vancomycinre és teicoplaninra érzékeny Enterococcus species (sp.) tenyészett ki, így a meropenemterápiát vancomycinnel egészítettük ki, majd a meropenemet nyolc nap után elhagytuk. Tekintettel a tracheából még mindig tenyésző A. baumannii-ra és a sebváladékból tenyésző Escherichia coli-ra, a rezisztenciavizsgálatok eredményeinek birtokában imipenemkezelést indítottunk.
A 15. ápolási napon vett tracheamintából már karbapenemekre sem érzékeny, multirezisztens A. baumannii (MACI) tenyészett ki, így a terápiát colomycin adásával egészítettük ki. A vancomycinterápiát nyolc, az imipenemet hét nap után leállítottuk, azonban egy nap után ismét láz, jelentős gyulladásosmarker-emelkedés lépett fel. Az elhúzódó karbapenemkezelést követően ciprofloxacin és clindamycin adását kezdtük meg a colomycin mellett. Előbbieket hét, utóbbit hat nap után hagytuk el.
A tracheából ismételten kitenyésző multirezisztens Acinetobacter miatt colomycin adásának prolongációja vált szükségessé, így három nap kihagyással ezt összesen 22 napig folytattuk. A tracheából emellett ciprofloxacinrezisztens Pseudomonas aeruginosa tenyészett, így a ciprofloxacin+clindamycin kombinációt imipenem/cilastatin-ra cseréltük, amelyet nyolc napig folytattunk.
Az alkalmazott kombinált antibiotikus kezelések ellenére a P. aeruginosa a tracheaváladék mellett az orrváladékban és a sebváladékban, majd a hemokultúrában is megjelent. Tracheaváladékban A. baumannii a 44. ápolási napig tenyészett. A 33. ápolási napon sebváladékból ESBL-termelő K. pneumoniae (K. pn.), imipenemre csak mérsékelten érzékeny P. aeruginosa és colomycin mellett már csak tobramycinre érzékeny A. baumannii tenyészett, így az imipenemet meropenemre cseréltük, tobramycinkigészítést alkalmaztunk.
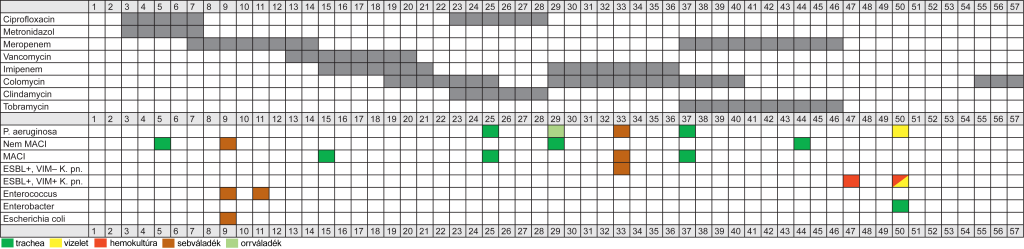
A többször visszatérő szeptikus állapotra tekintettel, számos alkalommal végeztünk góckutatást, amelyek során gócos, abscedáló pneumonia, kiterjedt sinusitis maxillaris és ethmoiditis, valamint perzisztáló ileus mutatkozott. A részletes leoltási eredményeket az 1. táblázat mutatja.
1. táblázat. Részletes leoltási eredmények

Az antibiotikus kezelések mellett az 50. ápolási napra a vizeletben és a hemokultúrában olyan csökkent karbapenemérzékenységű, ESBL+, VIM-4+ K. pneumoniae jelent meg, amely az elvégzett rezisztenciavizsgálatok során a vizsgált antibiotikumok közül egyikre sem mutatott érzékenységet, így kezelését colomycin adásával végeztük, azonban az 52. ápolási naptól fellángoló ismételt szeptikus állapot már uralhatatlannak bizonyult, a beteg az 57 nap kiterjesztett intenzív terápiás ellátás ellenére elhunyt. Az antibiotikus kezelés és leoltási eredmények ápolási napok szerinti összefoglalóját a 2. táblázat mutatja.
2. táblázat. Az antibiotikus kezelés és a leoltási eredmények ápolási napok szerinti összefoglalója
A kórbonctani vizsgálat az operált bélszakasz és az anasztomózis egyik végének jelentős gyulladásos elfajulását, akut purulens peritonitist, az eredeti bélösszenövések feltehetőleg fedett perforációt okozó akut diverticulitis miatti létrejöttét, peritonitis talaján kialakult szeptikus belszerveket, bronchopneumoniát talált, amelyek együttesen többszervi elégtelenséghez, a már csökkent balkamra-funkció további súlyosbodásához vezettek.
Megbeszélés
A bakteriális fertőzések adekvát kezelése mind a mai napig számos kihívás elé állítja az orvostudományt. A nem megfelelő hatású vagy nem megfelelő időben alkalmazott antibiotikum a fertőzés eszkalálódását, ugyanakkor a túlzott antibiotikum-használat az egyre rezisztensebb kórokozók kialakulását, szelektálódását segíti elő.
A baktériumok antibiotikum-rezisztenciájának számos mechanizmusa ismert. Ezek egyike a β-laktám antibiotikumokkal szembeni rezisztenciát biztosító β-laktamáz enzim termelése. Az ESBL egy olyan β-laktamáz enzim, amely a széles spektrumú cefalosporinok oxymino-oldalláncának hidrolízisével fejti ki hatását, így ezen esetekben a karbapenemkezelés az első választandó eljárás.
Egyes baktériumok ugyanakkor képesek karbapenemáz enzim termelésére, amely a β-laktamázok egy külön csoportját képezik, amelyek nem csupán az oxymino-cefalosporinokkal és cephamycinekkel, hanem a karbapenemekkel szemben is rezisztenciát biztosítanak. Az egyik ilyen karbapenemázcsoport a VIM, amely Magyarországon elsődlegesen P. aeruginosa törzsekben volt megtalálható (2).
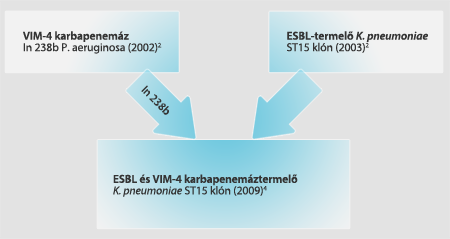
Bizonyos körülmények között rezisztenciamechanizmusok át is adódhatnak egyik baktériumról a másikra, például a P. aeruginosa törzsekben megtalálható, a VIM-4 típusú karbapenemáz termeléséért felelős gént hordozó, In238b elnevezésű integron átkerülhet más baktériumspeciesekbe is, esetünkben például egy ESBL-termelő K. pneumoniae törzsbe (3) (1. ábra).
1. ábra. A P. aeruginosának a VIM-4 típusú karbapenemáz termeléséért felelős gént hordozó, In238b elnevezésű integronja átkerülhet az ESBL-termelő K. pneumoniae törzsbe
Az antibiotikumokkal szemben érzékenyebb kórokozók kezelése során, sajnos, lehetőség adódik különböző rezisztenciamechanizmusok kialakulására, illetve adott rezisztenciamechanizmussal bíró baktériumok szelektálódására. Esetünkben látható, hogy az egyébként szükséges antibiotikus kezelés mellett, esetleg az In238b integron átadódásával vagy az integront már korábban is hordozó törzs szelekciójával, egy olyan baktérium megjelenése volt megfigyelhető, amelynek antibiotikus kezelése az elérhető gyógyszerekkel és az akkori mikrobiológiai szakmai irányelvek szerint szinte lehetetlen volt (4).
Megjegyezzük, hogy a hasonló rezisztenciaprofillal rendelkező baktériumok kezelési elve jelenleg a kombinációs kezelésen alapul, amely a csökkent karbapenemérzékenység ellenére is valamilyen karbapenem típusú antibiotikum (imipenem, meropenem) és más hatékony szer, például colomycin együttes vagy többszörös kombinációban történő adását jelenti (5). A kezelés sikeressége – ahogy azt esetünkben is láthattuk –, sajnos, még így is kétséges. Az eset tanulságaként feltétlenül említendő továbbá, hogy a szeptikus góc lehetőség szerinti legkorábbi sebészi eradikációja alapvetően befolyásolja a kórállapot kimenetelét (6). Az alapbetegség lehető legjobb eliminálása nélkül az antibiotikus kezelés nem lehet elég hatásos.
Köszönetnyilvánítás
Köszönet illeti dr. Mühl Diána egyetemi docenst a beteg intenzív terápiás kezeléséért, valamint prof. dr. Bogár Lajos intézetvezetőt és dr. Mestyán Gyula főorvost értékes szakmai tanácsaikért.
Irodalom
1. Dellinger RP, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med 2013;39(2):165–228.
2. Libisch B, et al. Isolation of an integron-borne blaVIM-4 type metallo-beta-lactamase gene from a carbapenem-resistant Pseudomonas aeruginosa clinical isolate in Hungary. Antimicrob Agents Chemother 2004;48(9):3576–8.
3. Damjanova I, et al. Expansion and countrywide dissemination of ST11, ST15 and ST147 ciprofloxacin-resistant CTX-M-15-type beta-lactamase-producing Klebsiella pneumoniae epidemic clones in Hungary in 2005 – the new “MRSAs”? J Antimicrob Chemother 2008;62(5):978–85.
4. Melegh S, et al. Emergence of VIM-4 metallo-β-lactamase-producing Klebsiella pneumoniae ST15 clone in the Clinical Centre University of Pécs, Hungary. Clin Microbiol Infect 2014;20(1):OI27–9.
5. Tumbarello M, et al. Predictors of mortality in bloodstream infections caused by Klebsiella pneumoniae carbapenemase-producing K. pneumoniae: importance of combination therapy. Clin Infect Dis 2012;55(7):943–50.
6. NEFMI Aneszteziológiai és Intenzív Terápiás Szakmai Kollégiumi Tanácsa. A súlyos szepszis és a szeptikus sokk kezelésének szakmai irányelve. Protokollok.